电化学(3):伏安法
伏安法(Voltammetry)是一系列的电化学分析方法,通过分析施加电势与形成电流之间的函数关系来分析有关物质。伏安法包含阳极溶出法,循环伏安法等的方法。

伏安法广泛用于化学传感器及生物传感器,用于检测化学物质(气体成分、重金属)及生物物质(细菌、病毒)。学习伏安法需要具备电化学基础知识,可参考文章《电化学基础》。伏安法需要在浓度极化(Concentration Polarization)的条件下测量电化学电池中产生的电流。
激发信号(Excitation Signals)
伏安法中,激发信号被施加到电化学电池的工作电极并产生相应的电流,然后通过电势与电流的关系分析目标的物质。最常见的激发信号有以下四种:
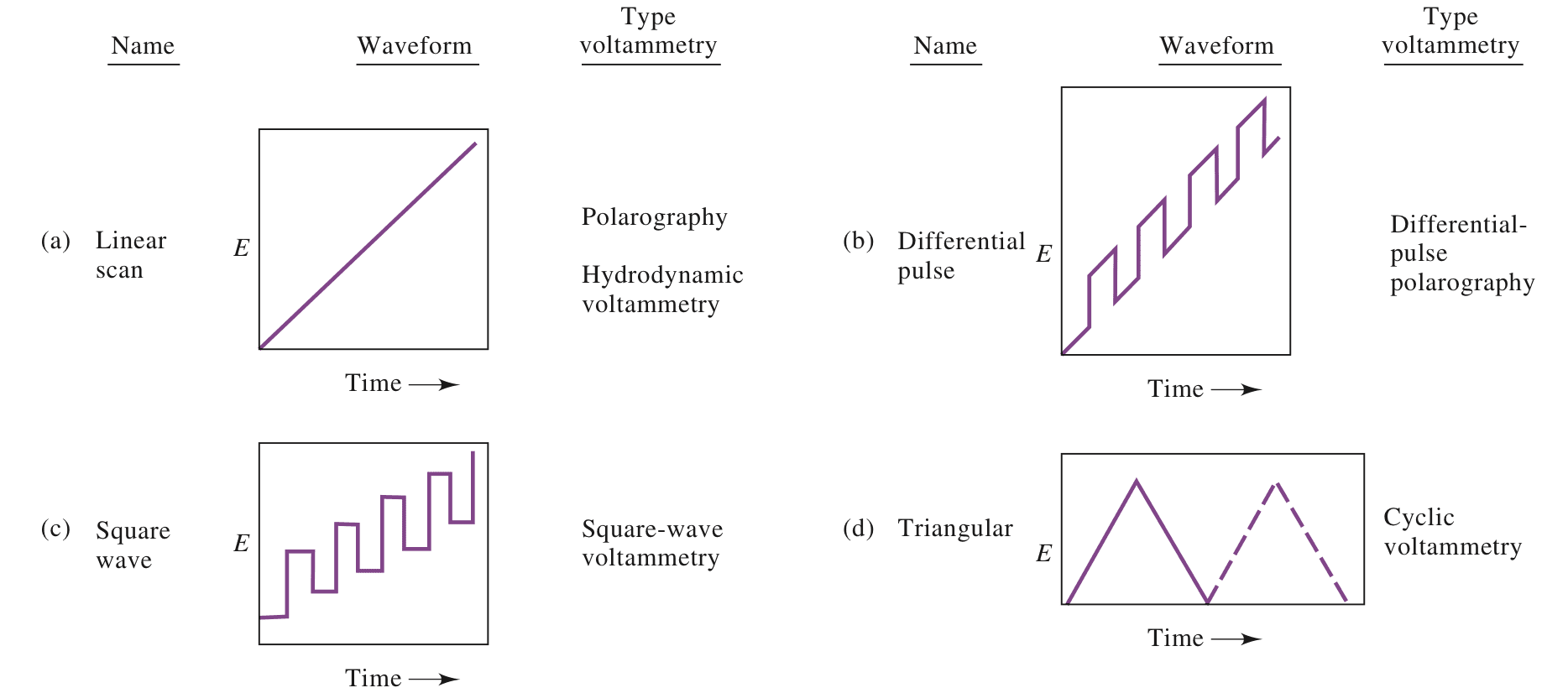
(a)为最经典的线性扫描技术,扫描电压线性增大,同时记录形成的电流值,最终分析电压与电流之间的关系。
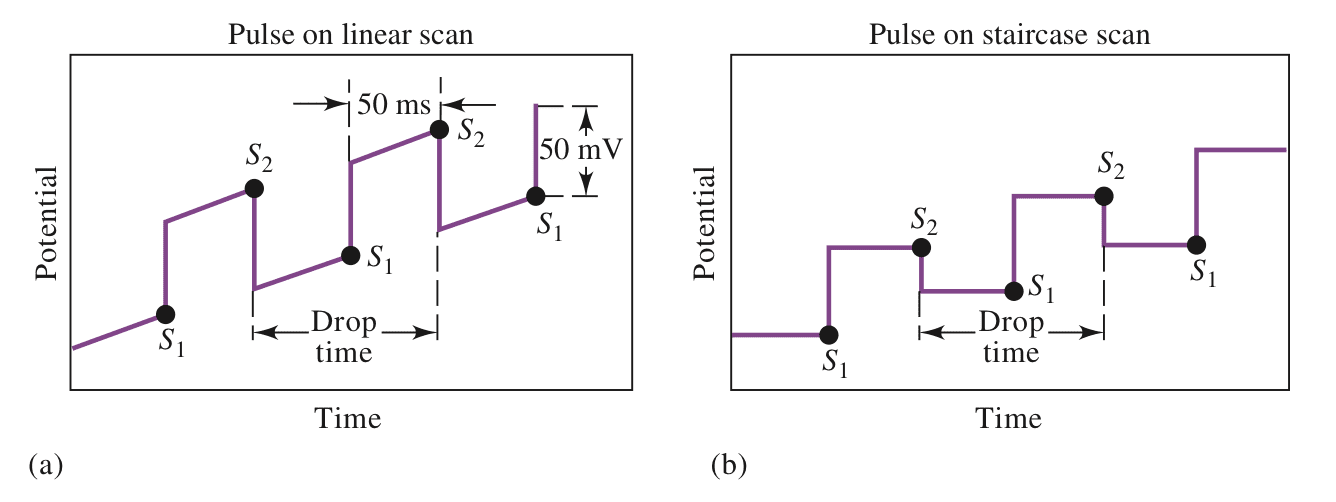
(b)(c)为脉冲激励信号,同时记录脉冲周期内电流。
(d) 为三角激励信号,电势在两个值之间循环:首先线性增加到最大值,然后以相同的斜率线性减少到其原始值。
线性伏安图(Voltammograms)
伏安图是施加电势(Applied Potential)与形成电流之间的关系曲线图,由电化学分析仪器绘制。由于伏安法有不同的激发信号,会产生不同类型的伏安图。
案例1:线性伏安图
下图展示的是线性扫描技术产生的伏安图。
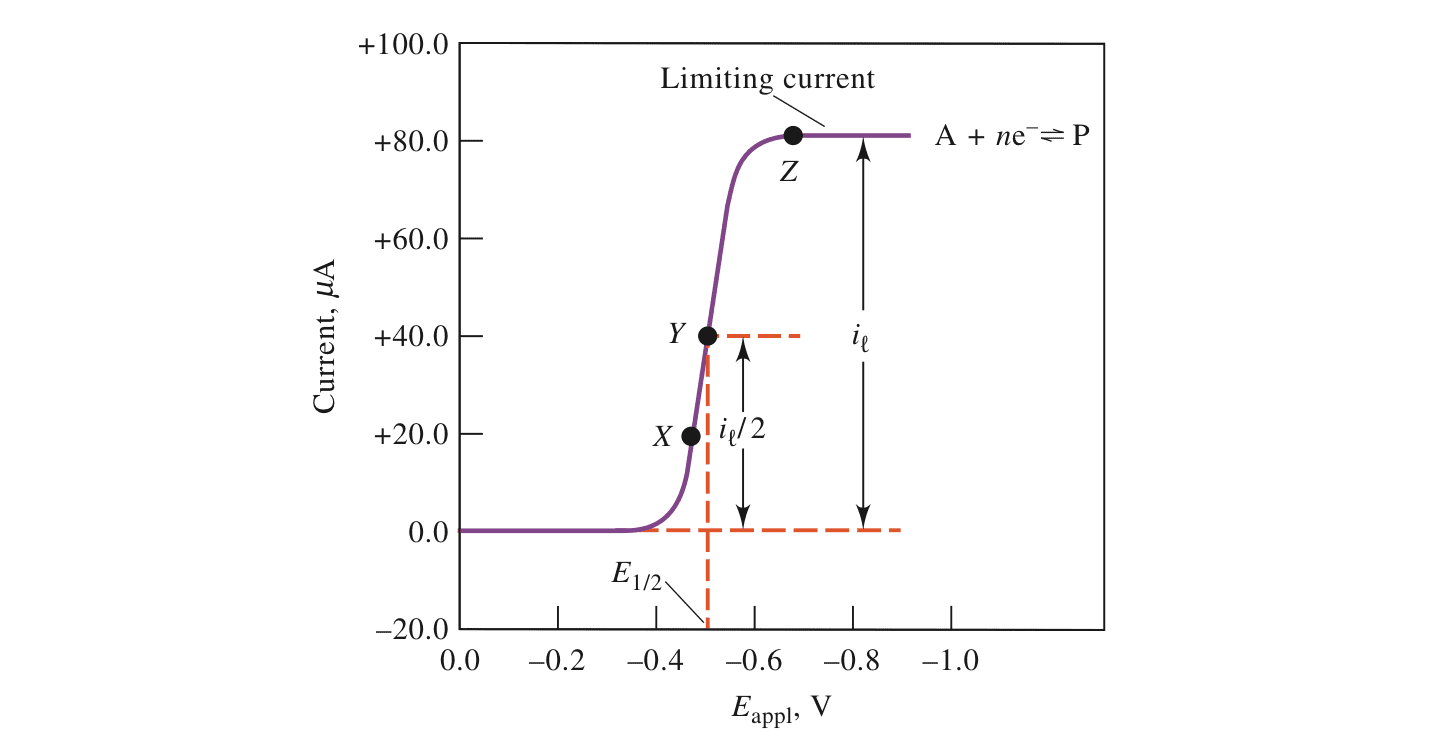
其中:
$$A + ne^- \rightleftharpoons P,\ E^0 = -0.26V$$
方便考虑假设A与P的浓度不发变化,A为$10^{-4}M$,P为$0.0M$。随着电势绝对值的增加,电流不断增大而达到限制电流$i_l$(Limiting Current)。限制电流产生的原因是物质传导到电极表面的速率是有限的,因此化学反应转移的电子也是有限的。限制电流与反应物质的浓度成正比。
$$i_l = kc_A$$
循环伏安法(Cyclic Voltammetry)
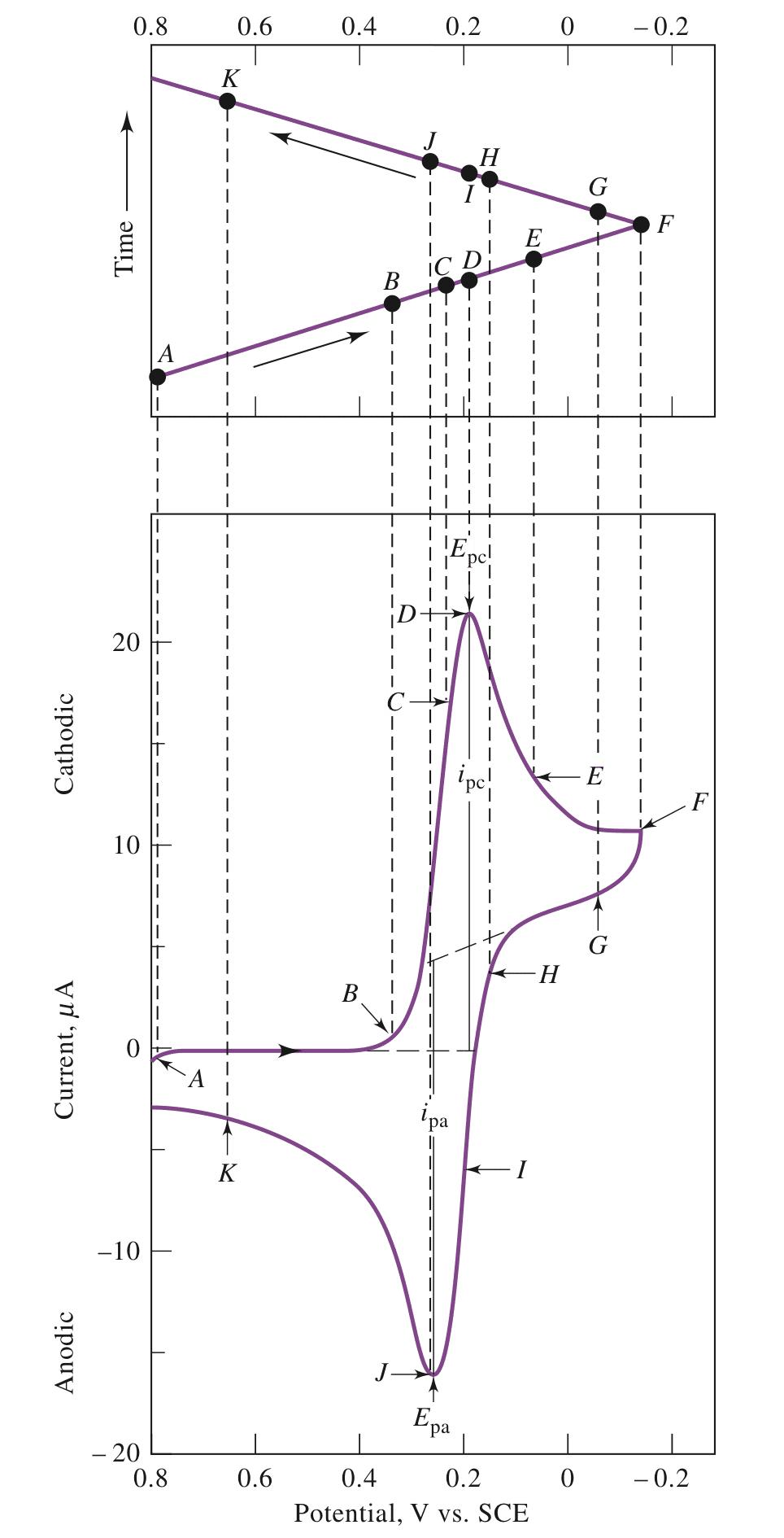
循环伏安法 (CV) 采用三角激励电势,并测量静置溶液中电极的电流响应。下图为三角激励信号的案例,其中-0.15V与+0.8V为转换电位。

案例2:
这里展示6mM的$K_3Fe(CN)_6$与1M的$KNO_3$溶液在三角激励信号的电流响应。
- A点为起始扫描电位,大小为0.8V 。在此电位下产生了微小的阳极电流,水被氧化成氧气。
- 0.7V到0.4V之间,即A到B之间没有明显的电流,表明没有发生氧化还原反应。
- 在B点之后,随着电流的减少,产生了阴极电流,发生了还原反应:
$$Fe(CN)_6^{3-} + e^- \rightleftharpoons Fe(CN)_6^{4-}$$
- B到D之间,随着电势的的减少,阴极发生的还原反应越剧烈,$Fe(CN)_6^{3-}$在电极表面的浓度减少,电流增大。
- D到F之间,随着扩散层越来越远离电极表面,电流迅速衰减。
- F点为扫描方向的转折点,但依旧是阴极电流,因为此时电势依旧可提供还原的电势。
- 当电流达到0的时候,随着电势的增大,电极转为阳极,电流为负。
脉冲伏安图(Pulse Voltammetry)
到 1960 年代,线性扫描伏安法不再是大多数实验室的重要分析工具。 这种曾经流行的技术使用减少的原因不仅是几种更方便的方法,也包括该方法固有的缺点:速度慢、设备不便,特别是检测限差。脉冲方法的发展克服了许多这些限制。 这里讨论两种最重要的脉冲技术,差分脉冲伏安法(Differential-Pulse Voltammetry)和方波伏安法(Square-Wave Voltammetry)。
1、差分脉冲伏安法
2、方波脉冲伏安法