电化学(1):基础知识
电化学是电学与化学的交叉科学,研究的是电势(作为一种可测量和定量的标量)与化学变化之间的关系。电化学常见的应用包括电池、燃料电池、腐蚀保护、电化学传感器等。

氧化还原反应
介绍电化学得先从氧化还原反应说起。一切化学反应都是氧化还原反应,会发生电子的转移。其中得到电子的物质叫氧化剂,失去电子的物质叫还原剂。
对于氧化还原反应:$Ce^{4+} + Fe^{2+} \rightleftharpoons Ce^{3+} + Fe^{3+}$
- $Ce^{4+}$得到电子,是氧化剂。氧化剂被还原而发生还原反应;
- $Fe^{2+}$失去电子,是还原剂。还原剂被氧化而发生氧化反应。
可以把氧化还原反应分解成两个半反应:
还原反应: $Ce^{4+} + e^- \rightleftharpoons Ce^{3+}$
氧化还原: $Fe^{2+} \rightleftharpoons Fe^{3+} + e^-$
氧化还原反应的方式有两种:一种是氧化剂与还原剂直接接触,而另外一种是将氧化剂与还原剂分别放置在不同的容器中,然后通过盐桥连接在一起。后者即是接下来要了解的电化学电池。
总结:
氧化还原反应定义了氧化剂,还原剂,氧化反应,还原反应。
- 化学反应中得到电子的物质为氧化剂,氧化剂被还原而发生还原反应;
- 化学反应中失去电子的物质为还原剂,还原剂被氧化而发生氧化反应。
这概念必须牢记于心
电化学电池(Electrochemical Cell)
电化学电池是一种装置,可以实现电能与化学能之间的相互转换。电化学电池通常有两个电极,一个叫阳极(Anode),另一个叫阴极(Canode)。
发生氧化反应的电极是阳极,比如:
$2Cl^- \to Cl_2 + 2e^-$
发生还原反应的电极是阴极,比如:
$O_2 +4e^- +4H^+ \to 2H_2O$
总结:
只要是发生氧化反应的电极就是阳极,发生还原反应的电极就是阴极。
- 阳极发生氧化反应:还原剂被氧化而发生氧化反应,还原剂是反应中失去电子的物质。
- 阴极发生还原反应:氧化剂被还原而发生还原反应,氧化剂是反应中得到电子的物质。
需要注意阳极、阴极与电池的正极、负极的区别。接下来会进一步讲解。
电化学电池有两种类型,一种是原电池(Galvanic Cells),另一种是电解槽(Electrolytic Cells)。
1、原电池
原电池可将化学能转化为电能,且两电极之间的反应可自发产生。阳极发生氧化反应,阳极的还原剂失去电子而有电子流出;阴极发生还原反应,阴极的氧化剂得到电子而有电子流入。因此电子通过外部的导线从阳极流向阴极,由于电流方向与电子移动方向相反,阳极被标为原电池的负极,阴极被标为原电池的正极。
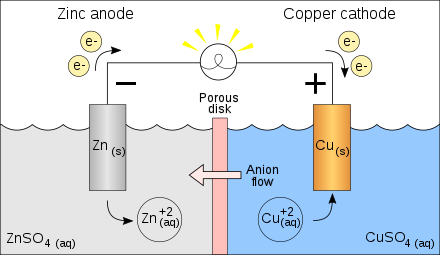
案例1
将以下反应设计成一个原电池
$$2Ag^+ + Cu(s) \rightleftharpoons 2Ag(s) + Cu^{2+}$$
在开路情况下两电极之间不会有电流通过,测得电极之间的电势差为0.412v,表示化学反应的趋势。
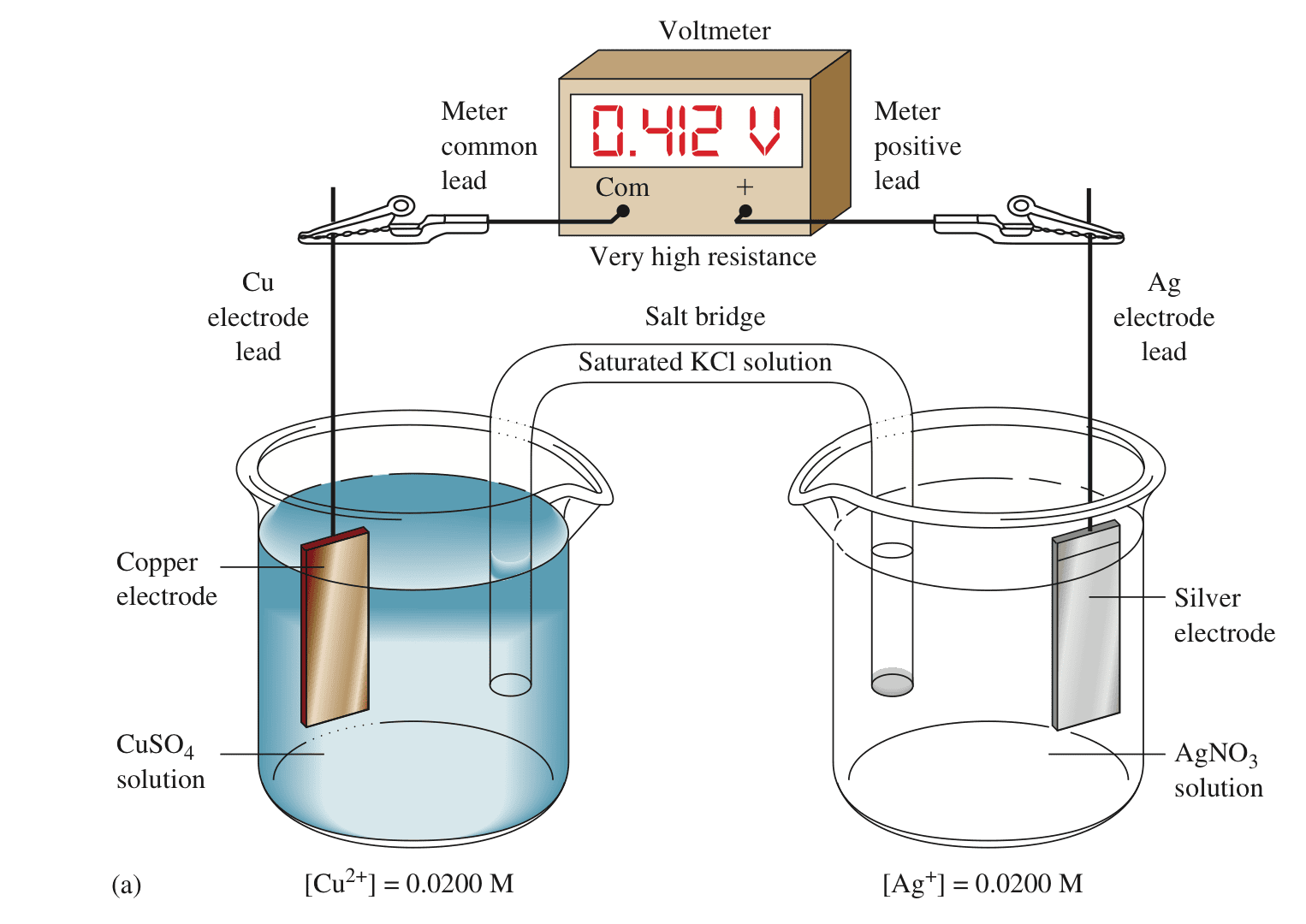
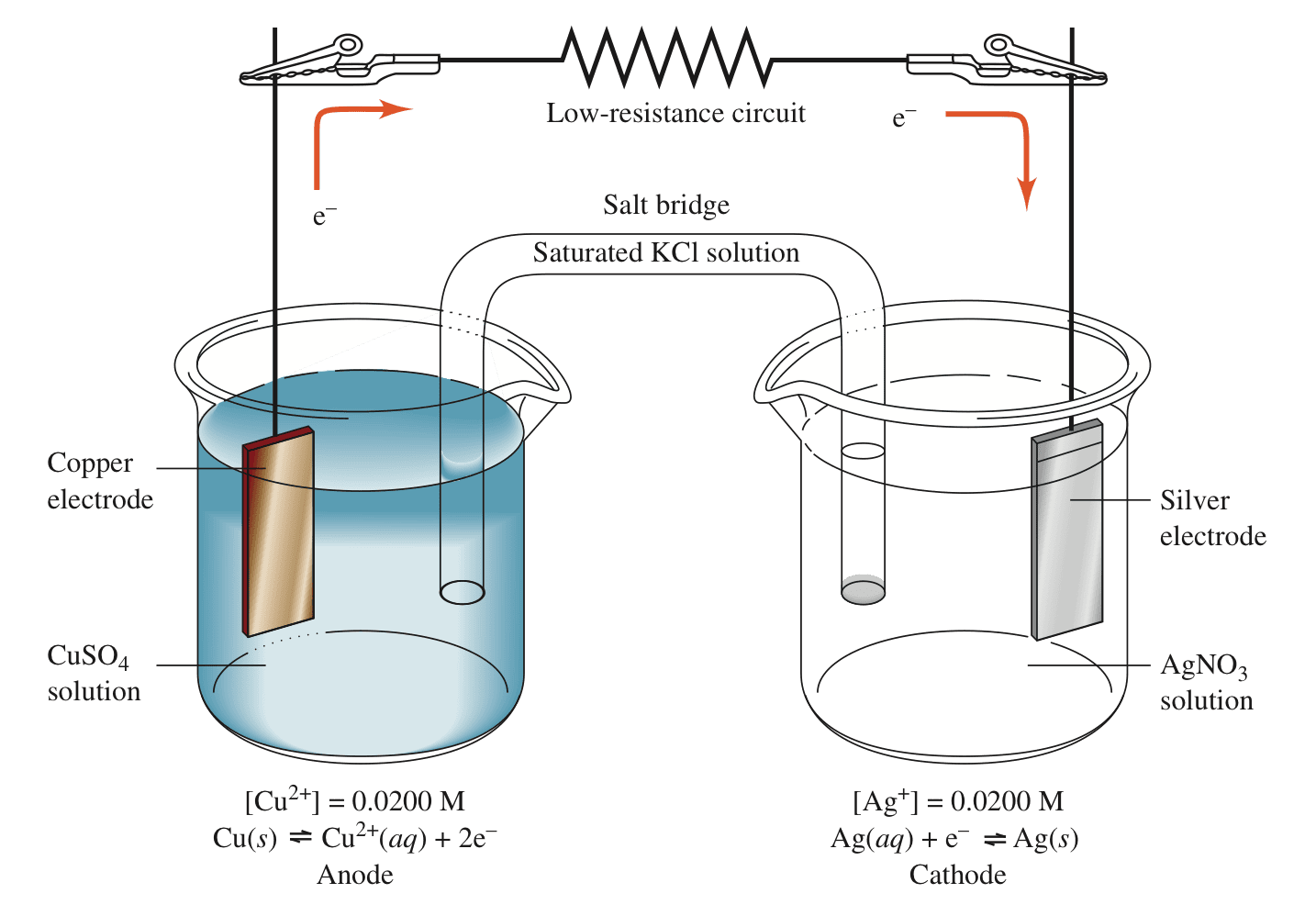
如果用电阻较小的导线将两个电极连接起来,电子会自发地从原电池的阳极流向阴极。铜电极为阳极,发生氧化反应;银电极为阴极,发生还原反应。
阳极(铜)发生氧化反应:$Cu \rightleftharpoons Cu^{2+} + 2e^-$,为原电池的负极;
阴极(银)发生还原反应:$Ag^+ + e^- \rightleftharpoons Ag$,为原电池的正极。
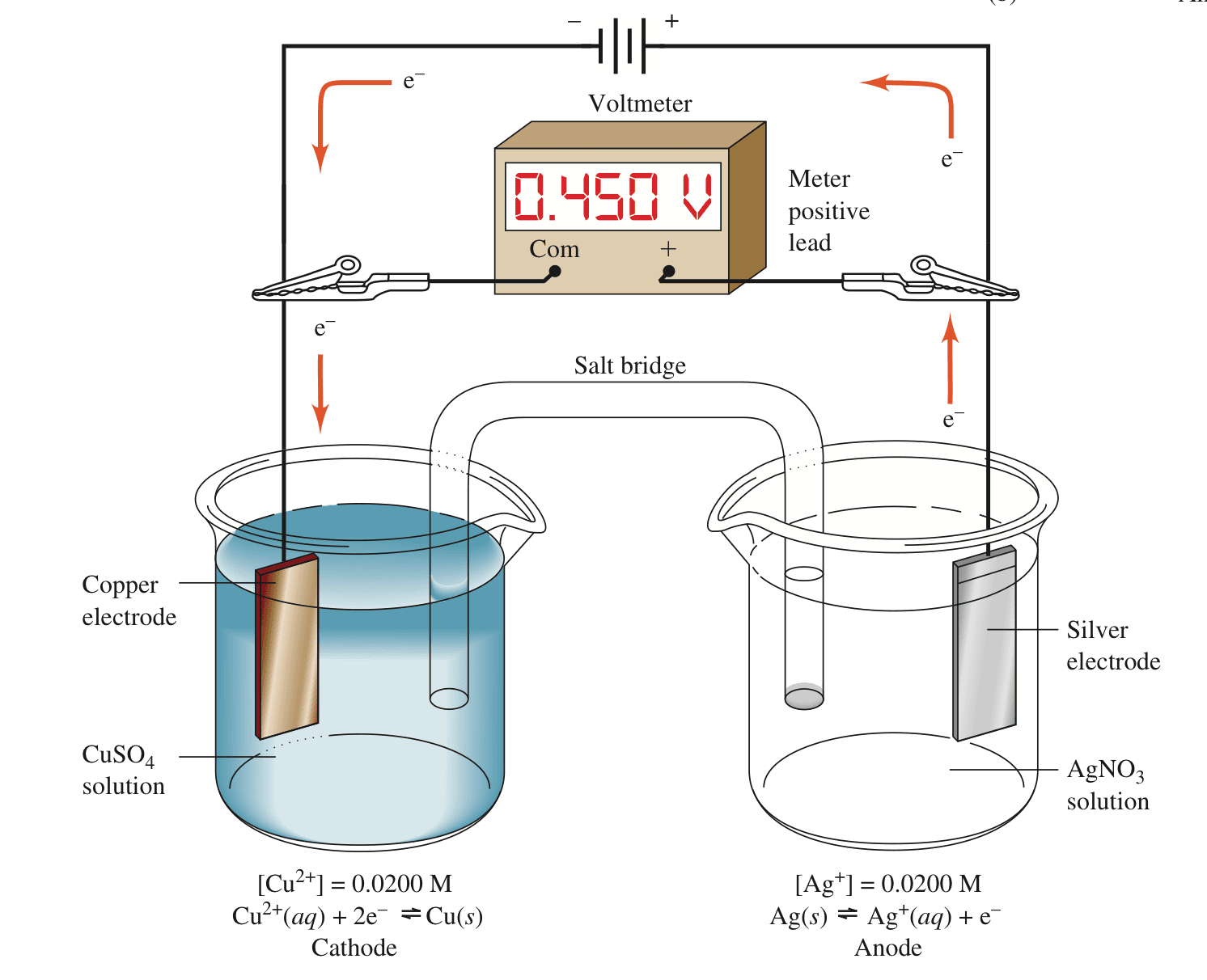
2、电解槽
电解槽可将电能转化为化学能,但需要外接电压。如果案例1的原电池外接一个电势大于0.412v的电池,其中正极与银电极相连,负极与铜电极相连。由于外接电池的负极富含电子,使得铜电极周围的$Cu^{2+}$得到电子而被还原成铜,铜电极发生还原反应而变成阴极;由正极吸收电子,使得银电极失去电子被氧化成$Ag^+$,银电极发生氧化反应而变成阳极。
总结:
对于原电池(Galvanic Cell):阳极发生氧化反应,阳极的还原剂失去电子而有电子流出,为负极;阴极发生还原反应,阴极的氧化剂得到电子而有电子流入,为正极。
对于电解槽(Electrolysis Cell):外接电源正极连接的电极是阳极,发生氧化反应;外接电源负极连接的电极是阴极,发生还原反应。
电化学电池首先要判断是电解槽还是原电池,最后才能判断正负极性。
标准电池电势(Standard Cell Potential)与标准还原电势(Standard Reduction Potential)
原电池两个电极之间的电势差称为电池电势(Cell Potential),用$E_{cell}$表示,是驱动电子移动的电动势。$E_{cell}$的单位是伏,因此也称为电压。电池电势的大小与反应物的浓度,温度与压力有差。在标准条件下的电势叫标准电池电势(Standard Cell Potential),用$E_{cell}^0$表示。
标准电池电势完全取决于标准条件下阴极、阳极两个半电池电势(Half-Cell Potentials),即阴极与阳极之间的电势差。理论上我们可以测量所有阴极-阳极组合在标准情况下的电势差,列出一个标准电池电势的参考表格。实际上并不需要这样做,我们只需要测量每个半反应的标准电势。电池电势是两个半反应电池标准电势的电势差。
标准半电池电势可表示为$E_{red}^0$。如果知道了阴极与阳极的标准还原电势,那么标准电池电势可以表示为:
$$E^0_{cell} = E^0_{red}(Cathode) - E^0_{red}(Anode)$$
1、标准还原电势
由于单个电极的标准还原电势是无法测量的,因此引入了一个标准的参考电极:标准氢电极(Standard Hydrogen Electrod, SHE)。标准氢电极发生的化学反应及条件如下,而且规定SHE的标准还原电势为0.
$$2H^+(aq, 1m) + 2e^- \to H_2(g, 1 atm) \ E^0_{red} = 0V$$
标准氢电极既可以是阴极,也可以是阳极,具体取决于另外一个电极的特性,但电势都为0。如果是阴极,则$H^+$被还原成$H_2$;如果是阳极,则$H_2$被氧化成$H^+$。
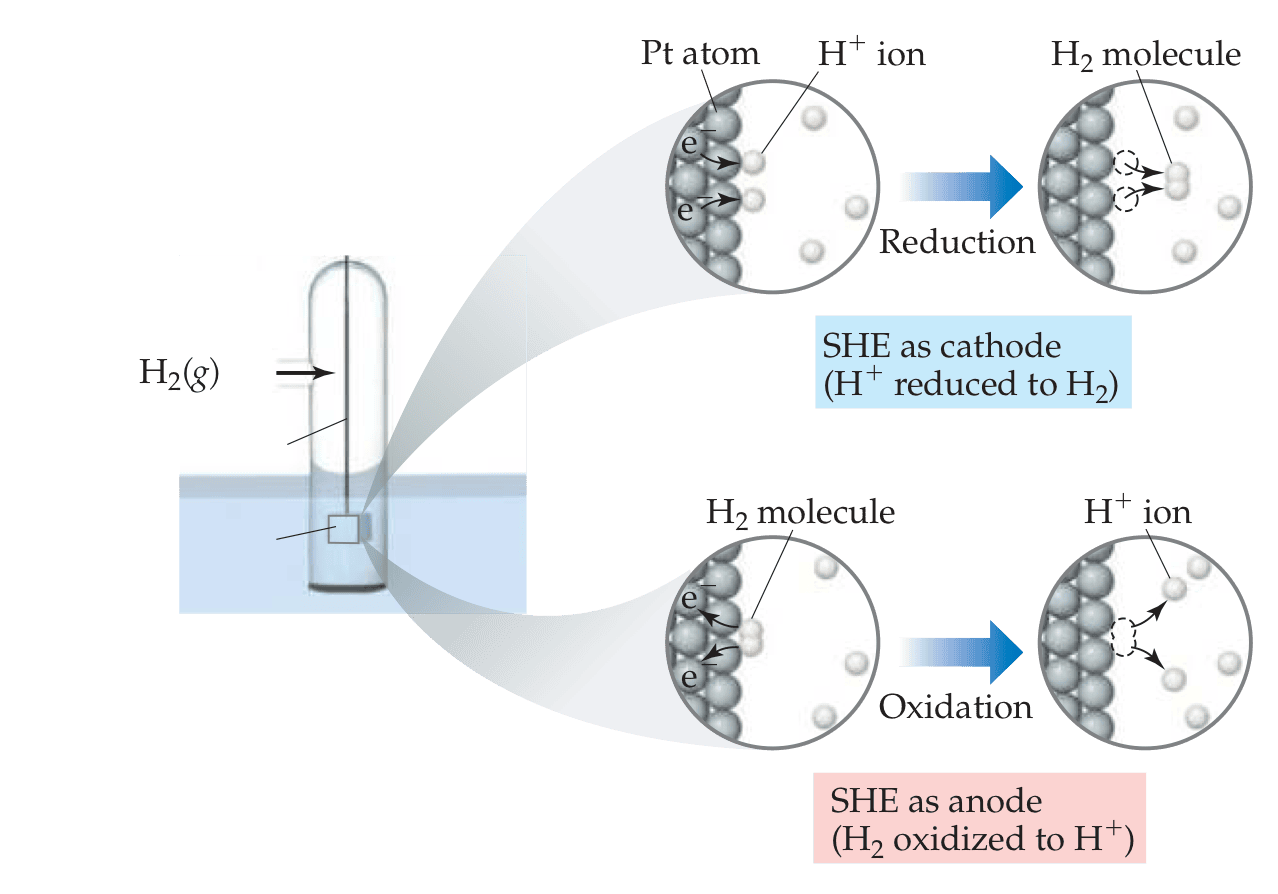
有了标准氢电极作参考,其它电极的标准还原电势都可以直接测量,并列成一个标准还原电势表。
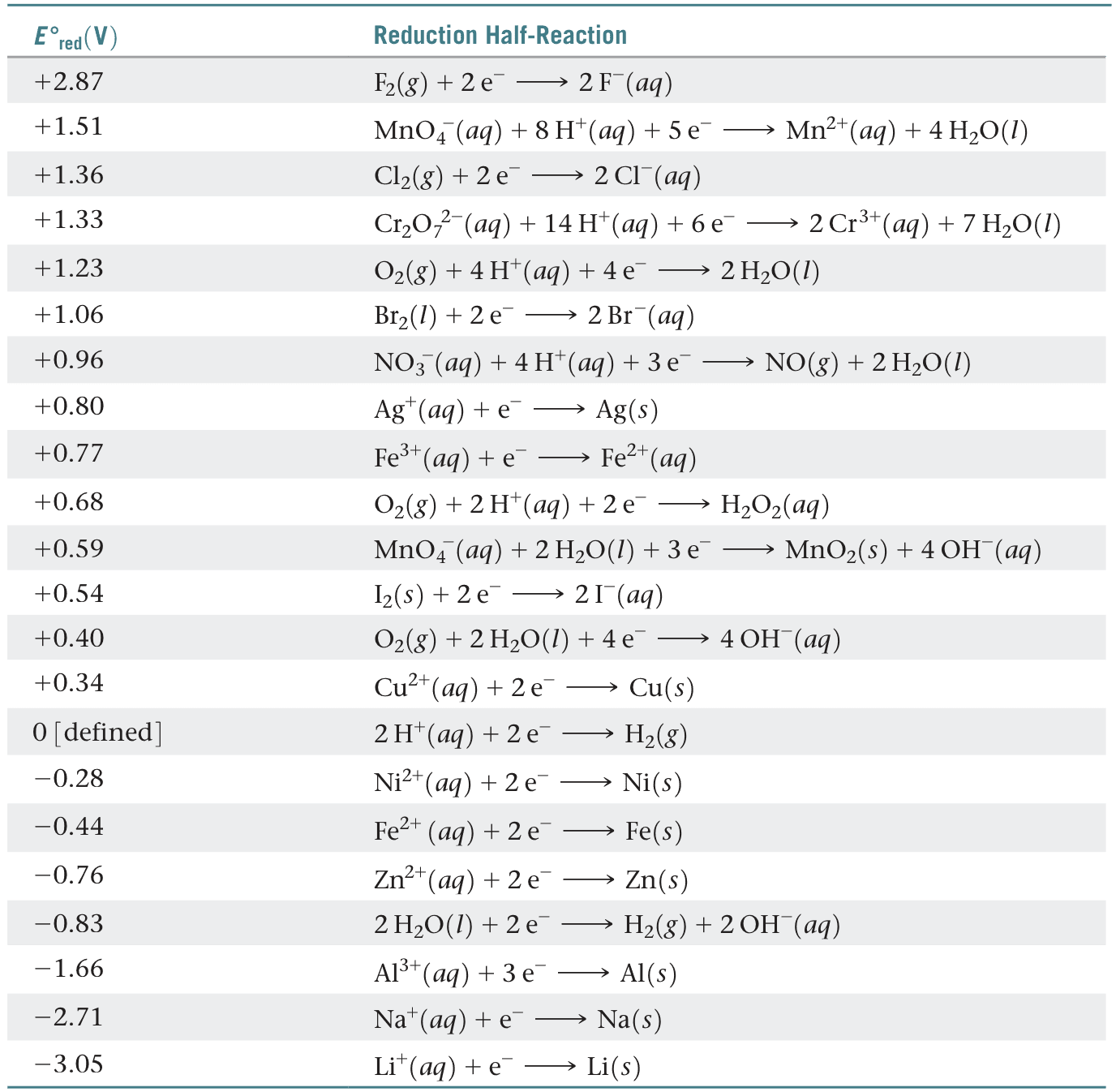
2、标准还原电势的应用
标准还原电势越大,物质越容易发生还原反应,物质的氧化性就越强。标准还原电势越小,物质越难于发生还原反应,物质的氧化性就越弱,但物质的逆反应越容易发生,还原性越强。
比如标准还原电势最大的$F_2$,越容易发生还原反应,即:
$$F_2(g)+ 2e^- \to 2F^-(aq)$$
标准还原电势最小的$Li^+$,越难发生还原反应,但更容易发生逆反应,即氧化反应:
$$Li(s) \to Li^+(aq) + e^-$$
能斯特方程(Nernst Equation):如何计算非标准状态下的电极电势
上一小节我们计算了标准的情况下半反应的标准还原电势,但实际应用并不能满足这个苛刻的条件。比如一个电池在放电的时候,化学反应在不断进行,里面的成分、温度等在不断变化。在这种情况下,如果计算电池电势呢?这里介绍最重要的方程:能斯特方程(Nernst Equation)
对于一个半反应:
$$aA + bB + \cdots + ne^- \rightleftharpoons cC +dD + \cdots$$
能斯特方程Nernst Equation可以表示为:
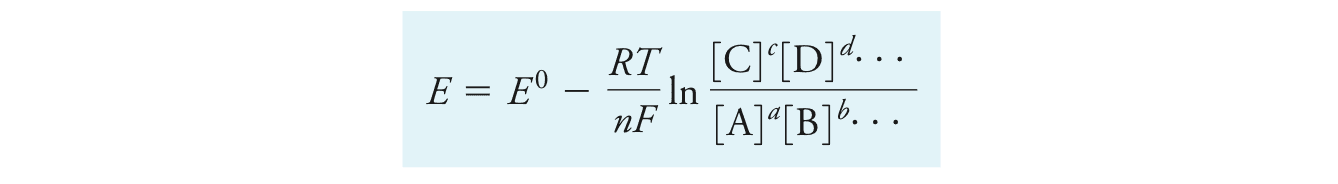
在T=25度时代入一些常数R, F,并转换为10为底的对数函数后得到:
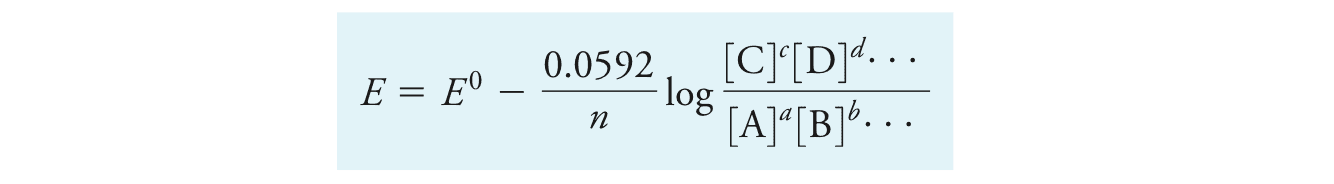
有了能斯特方程,便可以计算非标准情况下的电极的还原电势,进而可计算非标准情况下的电池电势。
至此,电化学基础知识已经介绍完毕。



